
20-40 % af alle patienter med inflammatorisk tarmsygdom har jernmangelanæmi, mens 35-75 % har jernmangel (1). Jernmangel og jernmangelanæmi er de mest almindelige systemiske komplikationer ved IBD. Det er et område, der ikke har fået tilstrækkelig opmærksomhed, mener Stefan Lindgren, professor emeritus ved Lunds Universitet og tidligere overlæge i gastroenterologi ved Skånes universitetssjukhus.
“Det er vigtigt at se på hele billedet, når man behandler patienter med langvarige sygdomstilstande. For patienter med inflammatorisk tarmsygdom (IBD) er det primære behandlingsmål at blive fri for inflammation, men det er ikke det eneste, der er vigtigt eller afgørende for deres velbefindende og for, at de kan leve deres liv fuldt ud. Patientrapporterede undersøgelser viser, at det er vigtigt at få god pleje, føle sig tryg, være velinformeret om og involveret i sin pleje og behandling og ikke lide af unødvendig træthed (fatigue) eller ekstraintestinale komplikationer. Kort sagt at have det bedst muligt – og her er det vigtigt at opnå en normal jernstatus,” siger Stefan Lindgren.
Han understreger vigtigheden af, at sundhedspersonalet interesserer sig for jernmangel og jernmangelanæmi, når de behandler patienter med IBD. Ifølge internationale retningslinjer bør patienter i den ikke-inflammatoriske fase have kontrolleret jernstatus hver sjette måned, mens patienter med aktiv sygdom bør kontrolleres hver tredje måned.
“Jernmanglen er i sig selv af stor betydning, da den har mange konsekvenser og også påvirker de kognitive evner. Anæmi og jernmangel reducerer generelt livskvaliteten og komplicerer på mange måder sygdomsforløbet ved IBD,” siger Stefan Lindgren.
Intravenøs jernsubstitution har længe været førstevalg ved behandling af jernmangel hos IBD-patienter. De tilgængelige præparater er effektive og sikre. Nyere studier viser dog, at ferricarboxymaltose ofte fører til hypofosfatæmi, der modvirker den forbedring af fatigue, som normaliseringen af jernstatus medfører. Desuden kan hypofosfatæmi på længere sigt forårsage skeletkomplikationer og muskelsvaghed.
Et nyt studie, PHOSPHARE-IBD (2), sammenlignede forekomsten af hypofosfatæmi efter behandling af jernmangelanæmi hos patienter med IBD med to forskellige lægemidler: ferricarboxymaltose, FCM (Ferinject) og ferriderisomaltose, FDI (Monofer). Det er det første dobbeltblindede randomiserede studie, hvor begge lægemidler blev givet i samme dosis. I alt 97 patienter deltog; halvdelen af patienterne fik FCM, og halvdelen fik FDI.
Selvom både FCM og FDI var lige effektive til behandling af jernmangelanæmi, viste studiet, at FCM var forbundet med en signifikant højere forekomst af hypofosfatæmi (51,0 %) sammenlignet med FDI (8,3 %).
Ønsker du mere information om PHOSPHARE-IBD-studiet, klik her: Study Presentation | PHARMACOSMOS

Professor emeritus ved Lunds Universitet, Stefan Lindgren
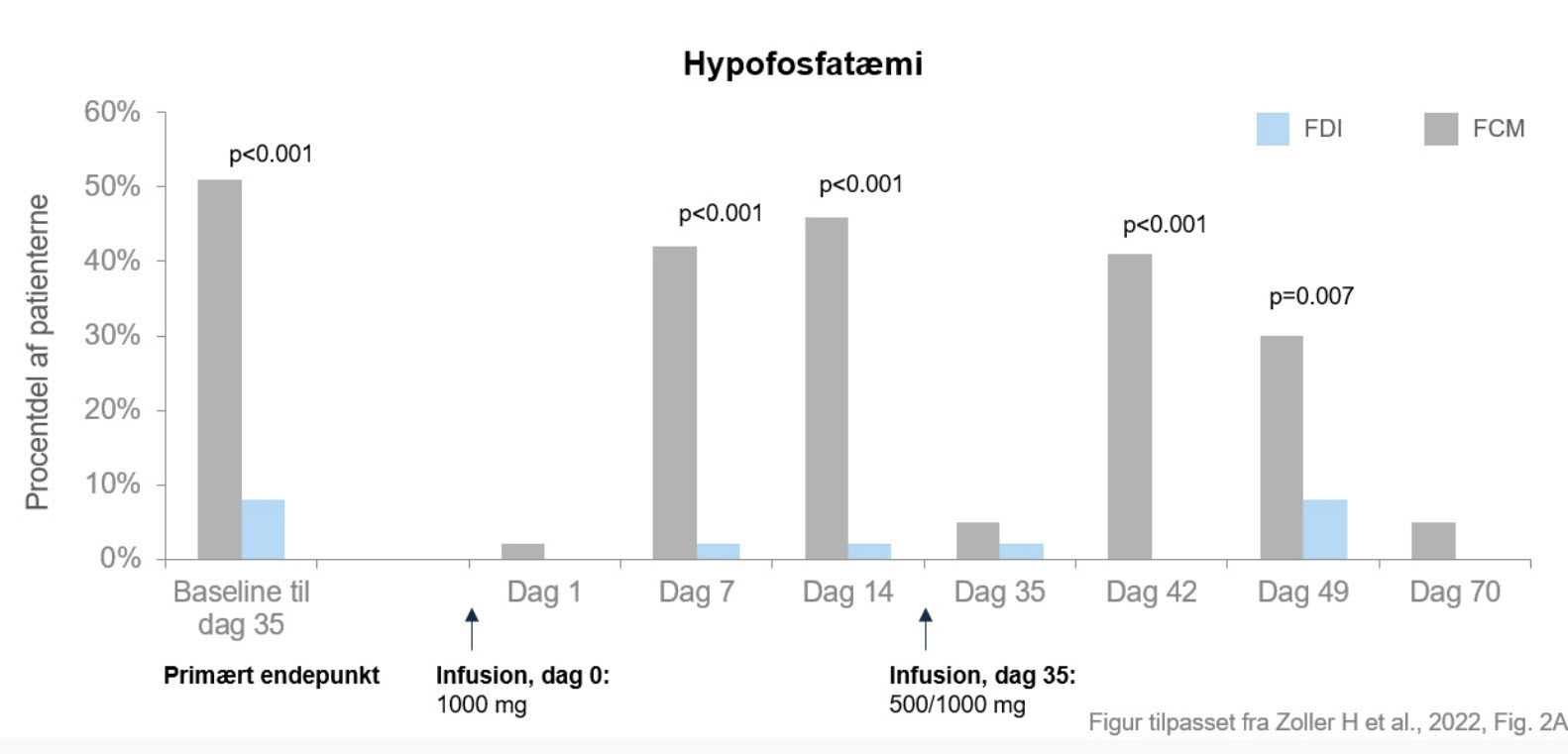
Alle (med undtagelse af to) patienter fik den første infusion af 1.000 mg FDI eller FCM på dag 0. Det primære endepunkt – incidensen af hypofosfatæmi (defineret som S-fosfat <2,0 mg/dl) på et hvilket som helst tidspunkt efter den første dosis indtil dag 35 – var 8,3 % (n=4/48) i FDI-gruppen og 51,0 % (n=25/49) i FCM-gruppen.
“Dette studie bekræfter, at jernmangel og jernmangelanæmi ofte ses hos IBD-patienter. Det bekræfter også, at begge lægemidler effektivt behandlede jernmangelanæmien, og at trætheden blev forbedret, men langsommere og i mindre grad med FCM sammenlignet med FDI. Den ringere effekt på træthed var forbundet med graden af fosfatmangel,” siger Stefan Lindgren.
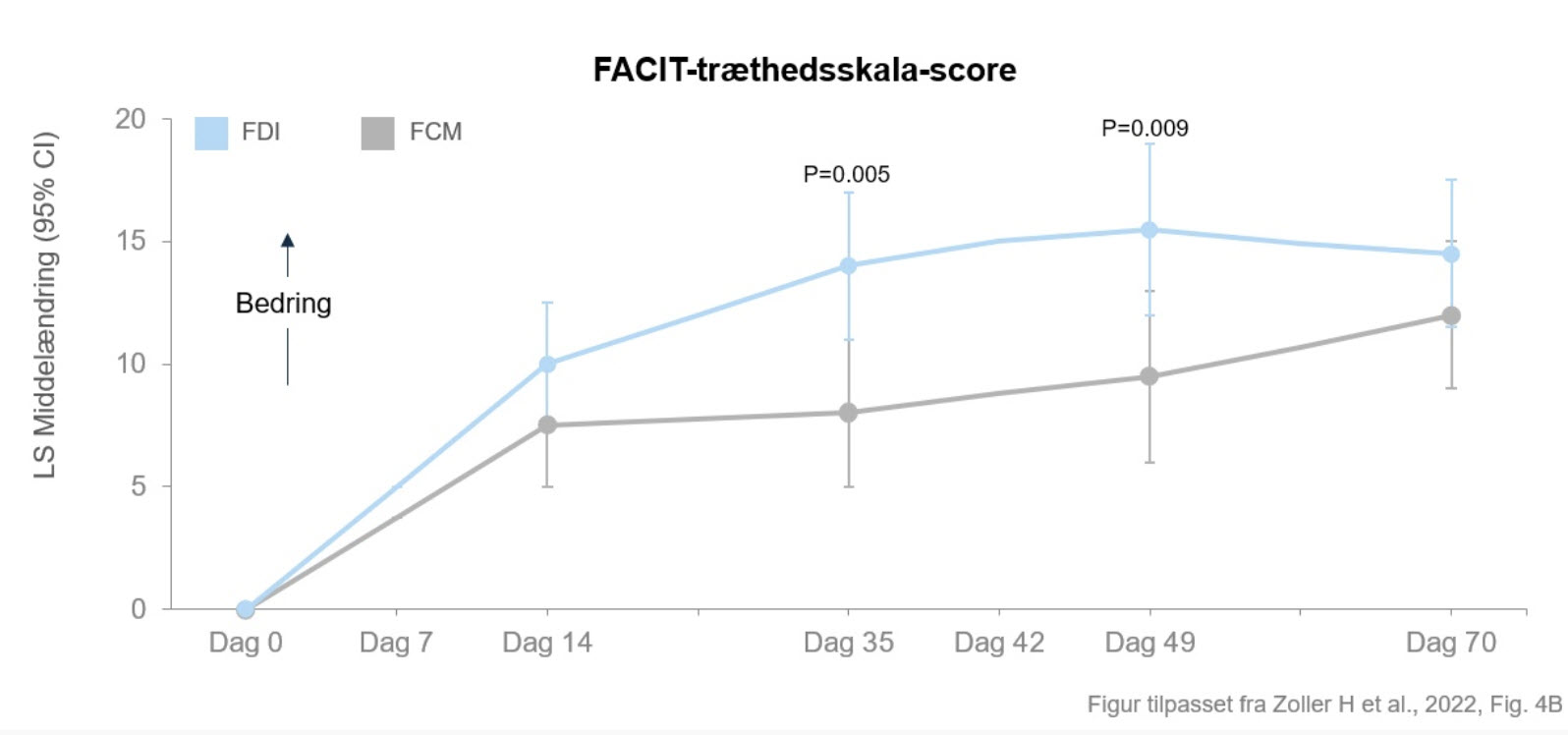
Begge lægemidler førte til en forbedring af træthedssymptomerne (FACIT-træthedsskala-score). Forbedringen i FACIT-træthedsskala-score over tid var betydeligt større for FDI sammenlignet med FCM på dag 35 og dag 49. Han understreger vigtigheden af at opretholde en god livskvalitet hos patienter med inflammatorisk tarmsygdom.
“Det er en klar fordel at bruge et præparat, der effektivt normaliserer jernstatus uden at forårsage andre biokemiske virkninger, der reducerer patientens livskvalitet og på sigt kan føre til andre komplikationer. Træthed-scoren, der blev brugt i PHOSPHARE-IBD-studiet, er et klinisk relevant mål for hypofosfatæmis negative indvirkning på livskvaliteten. Det bør man være opmærksom på, f.eks. ved at monitorere serumfosfat ved gentagen behandling med intravenøst jern,” siger Stefan Lindgren.
Referencer:
05-SCAN-29-06-2023.v1
Monofer® (ferriderisomaltose) forkortet produktresumé
Komplet produktresumé kan rekvireres vederlagsfrit ved henvendelse til Pharmacosmos A/S.
Lægemiddelform: Jern som ferriderisomaltose – mørkebrun opløsning til injektion/infusion. 1 ml = 100 mg jern tilgængelig som hætteglas eller ampul. Indikationer: Monofer anvendes til behandling af jernmangel når orale jernpræparater ikke kan anvendes eller ved manglende effekt. Samt ved klinisk behov for hurtig tilførsel af jern. Diagnosen skal baseres på laboratorieundersøgelser. Dosering: Max dosis per infusion er 20 mg jern/kg. Max dosis per bolusinjektion er 500 mg jern. Det optimale eller tilsigtede hæmoglobin niveau samt jerndepoter kan variere for forskellige patientgrupper. Der henvises til de officielle retningslinjer. Den kumulative jerndosis beregnes ved hjælp af enten Ganzoni formlen eller forenklet doseringstabel. Det anbefales at anvende Ganzoni formlen til patienter der sandsynligvis vil kræve en individuelt tilpasset dosis, eksempelvis patienter med anoreksi, kakeksi, svær overvægt, graviditet eller anæmi forårsaget af blødning. Administration: Monofer bør kun administreres, når et personale, der har erfaring med at vurdere og håndtere anafylaktiske reaktioner, er umiddelbart tilgængelige i et miljø, hvor der er adgang til komplet genoplivningsudstyr, herunder lægemidler til genoplivning (adrenalin, antihistaminer og/eller kortikosteroider). Patienten skal observeres i mindst 30 minutter efter hver Monofer injektion. Monofer kan indgives uopløst eller opløst i 0,9% natriumkloridopløsning. Hver IV jernadministration er forbundet med risikoen for en overfølsomhedsreaktion. For at minimere risikoen bør antallet af enkelte IV jernadministrationer holdes på et minimum. Doser op til 1000 mg jern indgives over en periode på mindst 15 min – og doser over 1000 mg indgives over en periode på mindst 30 min. Monofer bør ikke anvendes til personer under 18 år. Kontraindikationer: Kendt alvorlig overfølsomhed over for andre parenterale jernpræparater. Anæmi, der ikke skyldes jernmangel. For højt jernniveau eller dårlig udnyttelse af jern. Overfølsomhed overfor det aktive stof, over for Monofer eller øvrige indholdsstoffer. Dekompenseret leversygdom. Særlige advarsler og forsigtighedsregler: Parenteralt administrerede jernpræparater kan forårsage overfølsomhedsreaktioner, herunder alvorlige og potentielt dødelige anafylaktiske reaktioner. Der er også rapporteret overfølsomhedsreaktioner efter tidligere uproblematiske doser af parenterale jernkomplekser. Der har været rapporter om overfølsomhedsreaktioner, som progredierede til Kounis syndrom. Risikoen er øget for patienter med kendte allergier, herunder lægemiddelallergier, hos patienter, der lider af svær astma, eksem eller anden atopisk allergi, og for patienter med andre immunologiske eller inflammatoriske lidelser. Hvis der opstår overfølsomhedsreaktioner eller tegn på intolerans, skal behandlinges stoppes øjeblikkeligt. Hos patienter med kompenseret leverdysfunktion må parenteral jern kun indgives efter en grundig risk/benefit vurdering. Indgivelse af jern skal undgås hos patienter med dysfunktionel lever, hvor jernoverload er en fremskyndende faktor. Nøje monitorering af jernstatus anbefales for at undgå jernoverload. Bør bruges med forsigtighed til patienter med akut eller kronisk infektion. Monofer bør ikke anvendes til patienter, der har bakteriæmi. Hypotension kan opstå, hvis IV injektionen gives for hurtigt. Der skal udvises forsigtighed for at undgå paravenøs lækage ved indgivelse af Monofer. Interaktioner: Monofer bør ikke gives samtidigt med orale jernpræparater, da absorptionen af oralt jern kan reduceres. Kan medføre falske, forhøjede værdier af serum bilirubin og falske, lave værdier af serum kalcium. Graviditet: Der er kun begrænsede data fra brugen af Monofer hos gravide kvinder fra en undersøgelse med 100 eksponerede gravide kvinder. Det er derfor nødvendigt omhyggeligt at vurdere fordele og ulemper inden brug under graviditet. I sjældne tilfælde er der hos gravide kvinder med overfølsomhedsreaktioner observeret føtal bradykardi. Amning: kan anvendes. Bivirkninger: Almindelige (≥1/100 til <1/10): Kvalme, reaktioner på injektionsstedet. Ikke almindelige (≥1/1000 til <1/100): Overfølsomhed inkl. alvorlige reaktioner, hovedpine, paræstesi, dysgeusi, sløret syn, bevidsthedstab, svimmelhed, træthed, takykardi, hypotension, hypertension, brystsmerter, åndenød, bronkospasmer, abdominale smerter, opkastning, dyspepsi, forstoppelse, diarré, kløe, nældefeber, udslæt, rødme, øget svedafsondring, dermatitis, hypofosfatæmi, rygsmerter, myalgi, artralgi, muskelkramper, pyreksi, kulderystelser/rysten, infektion, lokal flebitisk reaktion, forhøjede leverenzymer. Sjældne (≥1/10000 til <1/1000): anafylaktiske reaktioner, dysfoni, tremor, ændret mental status, arytmi, angioødem, influenza lignende symptomer. Dato for SPC: 2022-11-11. Udleveringsgruppe: B. ATC: B03AC. Pakningsstørrelser: 5×1 ml, 5×5 ml, 2×10 ml. Dagsaktuel pris kan findes på www.medicinpriser.dk. Det fulde produktresumé kan læses på www.produktresume.dk Indehaver af markedsføringstilladelsen: Pharmacosmos A/S, Rørvangsvej 30, DK-4300 Holbæk.
Kontakt os:
E-mail: info@pharmacosmos.com
Tlf.-nr.: +45 5948 5959
Hjemmeside: www.pharmacosmos.com/nordic
PHOSPHARE-IBD study presentation
Cardio advertorial Denmark
Gastroenterology article 1
Gastroenterology article 2